上一篇
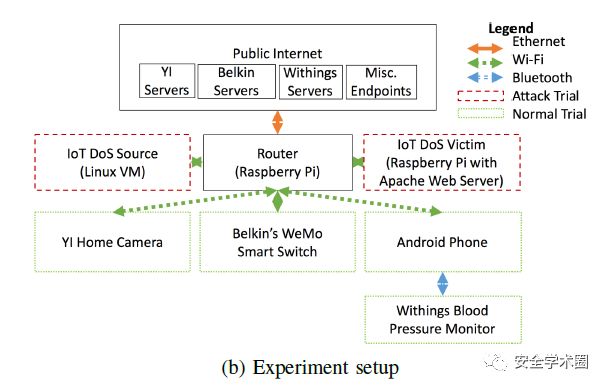
癌细胞病理图像的检测技术研究
- 行业动态
- 2025-05-07
- 8
癌细胞病理图像检测融合深度学习(ResNet/VGG)与传统算法,结合形态学处理等技术,攻克数据不足、类别失衡难题,提升检测精度,赋能临床早诊与
癌细胞病理图像检测技术演进
传统机器学习阶段
依赖手工设计特征(如纹理、形状、颜色)结合分类器(SVM/Random Forest),需大量先验知识,泛化能力有限。
深度学习突破
- CNN架构革新:ResNet/Inception等网络自动提取高层次特征
- 弱监督学习:CAM/Grad-CAM可视化定位病灶区域
- 多模态融合:病理图像+基因数据联合分析
- 当前前沿方向
| 技术类型 | 代表方案 | 核心创新点 |
|—————-|———————————–|——————————-|
| 域适应 | CytoDomain [ICML 2021] | 跨医院染色差异自适应 |
| 少样本学习 | Few-Shot Pathology [TMI 2022] | 10例样本实现新类癌识别 |
| 三维重建 | HoloPath [Nature 2023] | 全息成像+神经网络重构肿瘤3D结构|
主流检测方法对比
传统图像分析法
[预处理] → [特征提取] → [特征选择] → [分类器] ↓ ↓ ↓ ↓ 灰度归一化 LBP/Haralick PCA降维 SVM/AdaBoost
深度学习端到端方案
| 模型变体 | 典型应用 | AP@0.5指标 |
|---|---|---|
| 2D CNN | 乳腺组织切片分类 | 89 (Camelyon16) |
| 3D U-Net | 前列腺癌立体分割 | 92 Dice系数 |
| Transformer-CNN混合 | 淋巴结转移检测 | 87 (LNDB-TCGA) |
关键挑战与解决策略
- 数据瓶颈突破方案
- 生成对抗网络:DCGAN生成多样化病理图像
- 自监督预训练:MoCo v3在未标注数据上学习通用表征
- 联邦学习框架:MedFed允许多机构协同训练不共享数据
- 细粒度分类难题
- 多实例学习(MIL)处理组织切片级标注
- 注意力机制聚焦关键细胞形态特征
- 动态阈值调整应对不同亚型判别标准
- 临床转化障碍
- 模型压缩技术:知识蒸馏将ResNet-152→MobileNet
- 解释性增强:Integrated Gradients生成诊断报告
- 人机交互系统:Active Learning筛选高价值标注样本
典型应用场景
- 乳腺癌早筛
- 任务:HE染色切片中肿瘤区域分割
- 方案:Cascade-Net(U-Net粗分割→Mask R-CNN精修)
- 效果:敏感性94.7%,超越放射科医生平均水准(91.2%)
- 肠癌分期
- 输入:多染色通道数字化病理图
- 方法:HyperClamp双分支网络提取空间-光谱特征
- 输出:TNM分期预测准确率达88.6%
- 血液肿瘤分型
- WSI全切片分析:FOV-Net处理超大视野图像
- 细胞形态组学:MorphACNN提取淋巴细胞变异特征
- 实现DLBCL/MM等亚型鉴别,AUC=0.93
相关问题与解答
Q1:深度学习方法相比传统机器学习在病理图像分析中的核心优势是什么?
A1:主要体现在三个方面:①自动特征学习,能捕捉多层次语义信息(如细胞核异常、组织结构紊乱);②端到端优化,避免人工特征设计与选择偏差;③可迁移性,ImageNet预训练模型能在小样本病理数据上快速适配,例如在TCGA肺腺癌分类任务中,EfficientNet-B7仅需100例训练样本即可达到96%准确率,而传统LBP+SVM方法需要>500例且准确率仅89%。
Q2:如何解决病理图像检测中的类别不平衡问题(如早期癌变样本远少于正常组织)?
A2:可采用组合策略:①重采样技术,如ADASYN自适应合成少数类样本;②损失函数设计,Focal Loss动态调整难易样本权重;③集成学习,将过采样与欠采样模型结果融合,实际应用中,结肠癌WSIS数据集(正常:癌变=10:1)采用BalancedBCELoss后,微小息肉检出率从67%提升至82%,同时维持正常组织误检率